Diagnosespektrum und Patient(inn)enmerkmale
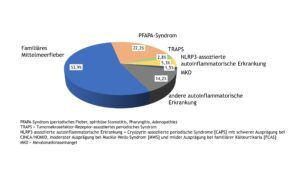
Das Diagnosespektrum der entzündlich-rheumatischen Erkrankungen im Kindes- und Jugendalter blieb gegenüber den Vorjahren relativ konstant. Patient(inn)en mit JIA machten knapp 60% aller dokumentierten Fälle aus (Abb. 1). Die Anteile der Patient(inn)en mit Vaskulitiden, Kollagenosen und autoinflammatorischen Erkrankungen (ohne NBO) waren mit 2% bis 8% deutlich geringer, was auf die Seltenheit dieser Krankheitsbilder hinweist. Das Spektrum der „sonstigen“ Diagnosen wurde von Schmerzsyndromen bzw. Arthralgien sowie infekt-assoziierten Arthritiden bestimmt.
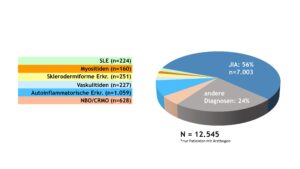
Abb. 1: Diagnosespektrum entzündlich-rheumatischer Erkrankungen im Kindes- und Jugendalter – Daten 2022 (Vergrößerung durch Klick)
Erwartungsgemäß dominierte unter den verschiedenen JIA-Kategorien die Oligoarthritis (OA) und machte knapp die Hälfte aller JIA-Fälle aus. Die mediane Krankheitsdauer der JIA-Patient(inn)en betrug 4 Jahre, deren medianes Alter bei Dokumentation lag bei 12 Jahren.
Juvenile idiopathische Arthritis
Medikamentöse und nicht medikamentöse Behandlung
Die Querschnittdaten der Jahre 2000, 2005, 2010, 2015, 2020 und 2022 spiegeln die Änderungen in der Therapie der JIA in den vergangenen Jahren wider, in denen krankheitsmodifizierende Therapeutika (Disease Modifying Anti-Rheumatic Drugs, DMARDs) etwas häufiger, systemische Glukokortikoide und nicht-steroidale Antirheumatika (NSAR) hingegen zurückhaltender verordnet wurden.
Unter den eingesetzten DMARDs (conventional synthetic = csDMARDs, biologic DMARDs = bDMARDs, targeted synthetic = tsDMARDs) war Methotrexat (MTX) nach wie vor die häufigste verordnete Substanz. Im Jahr 2022 wurden zum Dokumentationszeitpunkt 36% aller JIA-Patient(inn)en mit diesem Medikament versorgt. Etwa jede(r) 3. JIA-Patient(in) erhielt ein Biologikum. TsDMARDs werden bisher noch sehr selten eingesetzt (Abb. 2).
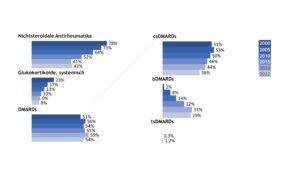
Abb. 2: Trends in der medikamentösen Therapie der JIA (Daten der Jahre 2000, 2005, 2010, 2015, 2020, 2022) (Vergrößerung durch Klick)
Bei der JIA insgesamt dominierten Etanercept (12%) und Adalimumab (11%) unter den eingesetzten Biologika. Beide Substanzen machten etwa 77% des Biologika-Einsatzes bei der JIA aus. Etanercept und Adalimumab wurden bei Kindern und Heranwachsenden mit JIA auch in Form von Biosimilars verabreicht. Im Jahr 2022 machten diese 27% (Etanercept) bzw. 42% (Adalimumab) der verordneten Präparate aus.
Neben der medikamentösen Therapie finden auch physiotherapeutische, ergo-therapeutische und psychosoziale Maßnahmen im multimodalen Behandlungskonzept der JIA Anwendung. Die Inanspruchnahme von Krankengymnastik, Ergotherapie und Patient(inn)en-/ Elternschulungen in den Jahren von 2000, 2005, 2010, 2015, 2020 und 2022 ist in Abbildung 3 dargestellt. Während die Verordnung von Krankengymnastik über die Zeit deutlich zurückging, zeigte sich eine gleichbleibende Inanspruchnahme bei der Ergotherapie. Über die Teilnahme an einer Eltern- bzw. Patient(inn)enschulungen berichteten im Jahr 2022 4% der Patient(inn)en mit JIA bzw. deren Eltern.
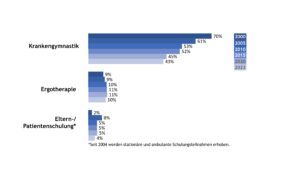
Abb. 3: Trends in der nicht-medikamentösen Therapie bei der JIA (Daten der Jahre 2000, 2005, 2010, 2015, 2020, 2022) (Vergrößerung durch Klick)
Stationäre Aufenthalte und Verweildauer
Abbildung 4 stellt die stationäre Behandlungshäufigkeit und kumulative stationäre Verweildauer pro Jahr von Patienten mit JIA über den Beobachtungszeitraum von 2000, 2005, 2010, 2015, 2020 und 2022 dar.
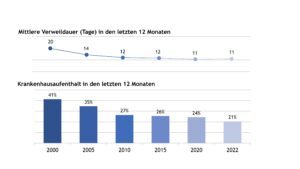
Abb. 4: Stationäre Behandlungshäufigkeit und kumulative Verweildauer pro Jahr (Daten der Jahre 2000, 2005, 2010, 2015, 2020, 2022) (Vergrößerung durch Klick)
In 2022 wurde etwa jede(r) fünfte JIA-Patient(in) für durchschnittlich 11 Tage im Jahr stationär behandelt.
Krankheitsaktivität der JIA
Die Einschätzung der Krankheitsaktivität erfolgte durch den Arzt anhand einer numerischen Ratingskala (NRS) von 0 bis 10 (0=bester Wert). Zudem wurde zur Quantifizierung der Krankheitsaktivität der clinical Juvenile Arthritis Disease Activity Score (cJADAS-10, Range 0-30) herangezogen, welcher neben dem Globalurteil des Arztes (NRS 0-10) die Anzahl der aktiven Gelenke (maximal 10) sowie die Patient(inn)en-/Elternglobalbewertung zum aktuellen Gesundheitszustand (NRS 0-10) berücksichtigt.
Über den Dokumentationszeitraum von 2000 bis 2022 nahm für die Gesamtgruppe der JIA der Anteil der Patient(inn)en mit einer klinisch inaktiven Erkrankung (bewertet anhand des cJADAS-10 bzw. der Globaleinschätzung des Arztes (NRS)) über die Zeit signifikant zu (Abb. 5). Für den cJADAS10 fanden die neuen, von Trincianti et al.[1] 2021 definierten cJADAS-Grenzwerte Anwendung (cJADAS-Score ≤1,1 für die Oligoarthritis / cJADAS-Score ≤2,5 für die Polyarthritis).
[1] Trincianti et al. Arthritis Rheumatol 2021;73:1966-75.
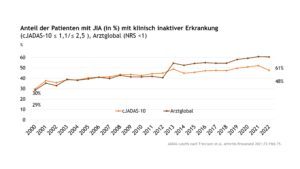
Abb. 5: Anteil der Patient(inn)en mit JIA (in %) mit klinisch inaktiver Erkrankung (cJADAS≤1,1 OA/ cJADAS≤2,5, PA oder Arztglobal < 1 (Daten der Jahre 2000-2022) (Vergrößerung durch Klick)
Patient(inn)enberichtete Outcomes
Zur Bewertung der Funktionsfähigkeit im Alltag wurde der CHAQ (Childhood Health Assessment Questionnaire) als international etabliertes Messinstrument angewendet, der in einer Eltern- und Jugendlichenversion vorliegt. Der CHAQ kann Werte zwischen 0 und 3 annehmen, wobei 0 keiner und 3 einer maximalen Einschränkung entspricht. Die Einschätzung der Schmerzstärke und des Gesundheitszustandes nahmen die Eltern bzw. die Patient(inn)en selbst auf einer Numerischen Ratingskala (NRS mit Werten zwischen 0 und 10, 0=bester Wert) vor.
Abbildung 6 veranschaulicht die Anteile der Patient(inn)en ohne Funktionseinschränkungen im Alltag (CHAQ=0), ohne Schmerzen (NRS<1) und ohne relevante gesundheitliche Beeinträchtigungen (NRS<1) über den Beobachtungszeitraum von 2000 bis 2022. Im Vergleich zur arztberichteten Krankheitsaktivität nahmen die Anteile der aus Patient(inn)en-/Elternsicht jeweils unbeeinträchtigten Patient(inn)en über die Zeit deutlich weniger oder kaum (Schmerzen) zu.
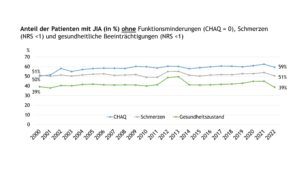
Abb. 6: Anteile der Patient(inn)en mit JIA (in %) ohne Funktionsminderungen (Patient(inn)en-/Elterneinschätzung, CHAQ=0), ohne Schmerzen (NRS<1) und ohne gesundheitliche Beeinträchtigungen (NRS <1) (Daten der Jahre 2000-2022) (Vergrößerung durch Klick)
Körperliche und sportliche Aktivität
Neben der Frage zur Teilnahme am Schulsport, die von den Eltern bzw. Jugendlichen selbst beantwortet wurde, enthielt die Kinder-KD auch Fragen zur Häufigkeit körperlicher und sportlicher Aktivitäten. Unabhängig von Alter und Geschlecht erfüllten über ein Drittel der Patient(inn)en im Alter von 3 bis 17 Jahren die Empfehlung der WHO von mindestens 60 Minuten sportlicher oder körperlicher Aktivität an 7 Tagen pro Woche. Deutliche Unterschiede bestanden zwischen den Altersgruppen. Patient(inn)en unter 12 Jahren erreichten unabhängig vom Geschlecht signifikant häufiger die Vorgabe der WHO (Abb. 7).
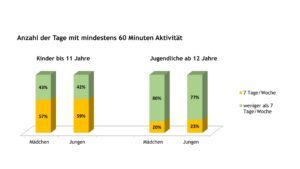
Abb. 7: Geschlechtsspezifische Angaben zum Anteil der Kinder und Jugendlichen mit JIA, die jeweils den Empfehlungen der WHO zur sportlichen bzw. körperlichen Aktivität nachkamen (Daten 2022) (Vergrößerung durch Klick)
Transitionskompetenz jugendlicher Patient(inn)en
Ausreichendes Krankheitswissen, Selbstmanagementfähigkeiten und Transferbereitschaft, d.h. eine gewisse Transitionskompetenz, gelten als wesentliche Voraussetzung für einen erfolgreichen Wechsel in die Erwachsenenmedizin. Um die Transitionskompetenz junger Rheumatiker zu erfassen, enthielt der Fragebogen für Jugendliche ab 16 Jahren erstmals den neu entwickelten und evaluierten Transition-KompAZ, ein standardisiertes modulares Instrument zur Erfassung der Transitionskompetenz, der Inanspruchnahme von sowie der Zufriedenheit mit transitionsspezifischen Leistungen. Die Erfassung der Transitionskompetenz erfolgte anhand von 11 Fragen, die anhand einer 5-stufigen Likert-Skala beantwortet wurden.
Im Jahr 2022 informierte sich laut Kinder-KD ca. jede(r) vierte junge Rheumatiker(in) (24%) zu seiner/ihrer rheumatischen Erkrankung, etwa jede(r) vierte (28%) kannte die Webseite „Mein Rheuma wird erwachsen.de“.
Etwas weniger als die Hälfte der Jugendlichen mit JIA im Alter ≥ 16 Jahre wiesen Defizite in der Transitionskompetenz auf. Hinsichtlich Krankheitswissen wurden Defizite bei Betroffenen vor allem hinsichtlich der Wirkungsweise der Rheumamedikamente, des Verlaufes der Erkrankung, der Familienplanung sowie des Einflusses von Substanzkonsum auf die rheumatische Erkrankung beobachtet (Abb. 8).
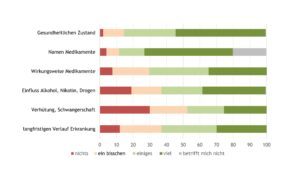
Abb. 8: Transitionskompetenz (Angaben in Prozent) – Krankheitswissen (Daten 2022) (Vergrößerung durch Klick)
Bezogen auf das Selbstmanagement gab etwa jede(r) zehnte Betroffene Schwierigkeiten an (Abb. 9).
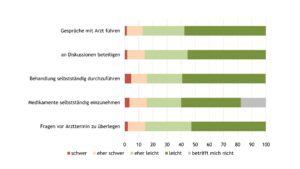
Abb. 9: Transitionskompetenz (Angaben in %) – Selbstmanagement (Daten 2022) (Vergrößerung durch Klick)
Autoinflammatorische Erkrankungen
Autoinflammatorische Erkrankungen (AID) beruhen auf Störungen (Defekten oder Dysregulationen) im angeborenen Immunsystem. Die Verteilung der in der Kinder-KD erfassten AID ist Abbildung 10 zu entnehmen.
Insgesamt wurden in 2022 1.059 Patient(inn)en mit AID dokumentiert.
Die nachfolgenden Auswertungen beziehen sich ausschließlich auf folgende Erkrankungen: i) das familiäre Mittelmeerfieber (FMF), ii) die NLRP3-assoziierte autoinflammatorische Erkrankung (= NLRP3-AID, Cryopyrin-assoziiertes periodisches Syndrom [CAPS] mit schwerer Ausprägung bei CINCA/NOMID, moderater Ausprägung bei Muckle-Wells-Syndrom [MWS] und milder Ausprägung bei familiärer Kälteurtikaria [FCAS]), iii) das TNF-Rezeptor-assoziierte periodische Syndrom (TRAPS) und iv) den Mevalonatkinasemangel (MKD) (=Mevalonazidurie [MVA] oder Hyper-IgD-Syndrom [HIDS]).
Medikamentöse Therapie
Die medikamentösen Behandlungen der Patient(inn)en mit FMF und NLRP3-assoziierter autoinflammatorischer Erkrankung unterschieden sich im Jahr 2022 relevant. Die Therapie des FMF änderte sich über die Zeit wenig. Colchicin war auch im Jahr 2022 die häufigste eingesetzte Substanz, Biologika erhielten nur 9% der FMF-Patient(inn)en (Abb. 11).
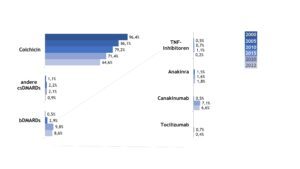
Abb. 11: Veränderungen in der medikamentösen Therapie bei Patient(inn)en mit FMF (Daten 2005, 2010, 2015, 2020, 2022) (Vergrößerung durch Klick)
Im Gegensatz zu Patient(inn)en mit FMF dominierten bei Patient(inn)en mit NLRP3-AID bDMARDs die Therapie, wobei ausschließlich IL-1-Inhibitoren, allen voran Canakinumab, Anwendung fanden (Abb. 12).
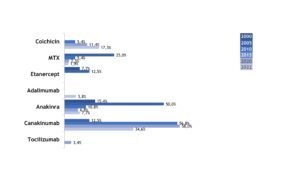
Abb. 12: Veränderungen in der medikamentösen Therapie bei Patient(inn)en mit NLRP3-AID (Daten 2005, 2010, 2015, 2020, 2022) (Vergrößerung durch Klick)
Auch Patient(inn)en mit TRAPS werden zunehmend mit bDMARDs behandelt. In den letzten Jahren kamen vermehrt IL-1-Inhibitoren zum Einsatz (Abb.13).
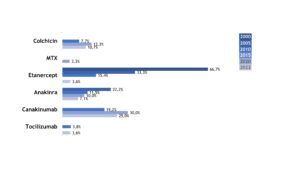
Abb. 13: Medikamentöse Therapie bei Patient(inn)en mit TRAPS (Daten der Jahre 2005, 2010, 2015, 2020, 2022) (Vergrößerung durch Klick)
Krankheitsaktivität und patient(inn)enberichtete Outcomes
Insgesamt wiesen aus ärztlicher Sicht knapp zwei Drittel der Patient(inn)en mit AID eine inaktive Erkrankung (Abb. 14) auf. Im Vergleich zum Jahr 2005 nahm der Anteil inaktiver Erkrankungen vor allem bei Patient(inn)en mit NLRP3-AID zu (2005: 15% vs. 2022: 60%). Somit scheinen Patient(inn)en mit dieser Erkrankung von den neuen Behandlungsmöglichkeiten besonders zu profitieren.
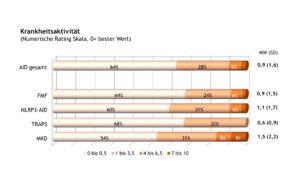
Abb. 14: Ärztliche Einschätzung der Krankheitsaktivität (gemessen mit einer NRS) bei Patient(inn)en mit AID (Daten 2022) (Vergrößerung durch Klick)
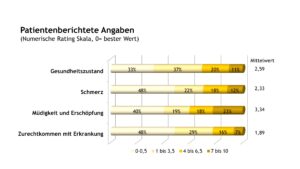
Unabhängig von der Form der AID bewertete etwa die Hälfte der Patient(inn)en ihren Gesundheitszustand mit sehr gut. Am schlechstesten schnitten die Patient(inn)en mit NLRP3-AID ab. Hier gaben nur 28% diesen mit sehr gut an.
Hinsichtlich der Schmerzbewertung zeigten sich Unterschiede zwischen den Patient(inn)en mit MKD und TRAPS gegenüber Patient(inn)en mit FMF und NLRP3-AID. In der erstgenannten Patient(inn)engruppe waren aktuell etwa 90% der Patient(inn)en schmerzfrei. Für Patient(inn)en mit FMF und NLRP3-AID traf dies nur auf etwa die Hälfte der Patient(inn)en zu.
Die patient(inn)enberichteten Outcomes änderten sich bei den Patient(inn)en mit FMF in den zurückliegenden Jahren geringfügig (Tab. 1). Jedoch gaben im Vergleich zu 2005 in 2022 deutlich mehr Patient(inn)en mit NLRP3-AID eine Verbesserung ihres Gesundheitszustandes an. Diese Ergebnisse reflektieren die Mittelwerte der Funktionseinschränkungen (gemessen mit dem CHAQ, Scorewerte zwischen 0 und 3), des allgemeinen Gesundheitszustandes und der Schmerzstärke (beides bewertet anhand einer NRS).
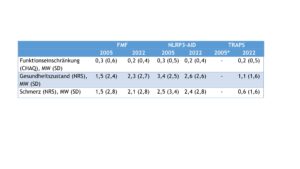
Tab. 1: Patient(inn)enberichtete Outcomes von Patient(inn)en mit AID (Daten der Jahre 2005 und 2022) (Vergrößerung durch Klick). MW Mittelwert / SD Standardabweichung.
*Fallzahl für Auswertungen unzureichend.
Juveniler systemischer Lupus erythematodes
Charakteristika
Im Jahr 2022 wurden insgesamt 224 Patient(inn)en mit einem juvenilen systemischen Lupus erythematodes (SLE) dokumentiert, davon lagen für 173 Patient(inn)en Angaben aus dem krankheitsspezifischen Arztbogen vor.
Ausgewählte Patient(inn)enmerkmale sind in der Tabelle 2 zusammengefasst.
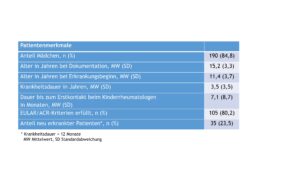
Tab. 2: Patient(inn)enmerkmale des juvenilen systemischen Lupus erythematodes (Daten 2022) (Vergrößerung durch Klick). * Krankheitsdauer < 12 Monate. MW Mittelwert / SD Standardabweichung.
Medikamentöse Behandlung
Die medikamentöse Therapie der Patient(inn)en umfasste vor allem die Gaben von systemischen Glukokortikoiden und krankheitsmodifizierenden Medikamenten (DMARDs). Über die Jahre von 2000 bis 2022 erhielten die SLE-Patient(inn)en in etwa 80% DMARDs (Abb. 15). Während Azathioprin über die Zeit seltener verordnet wurde, erhielten zunehmend mehr Patient(inn)en Antimalariamittel und Mycophenolat-Mofetil (MMF). Insgesamt erhielten 11% der erfassten Patient(inn)en mit SLE ein Biologikum.
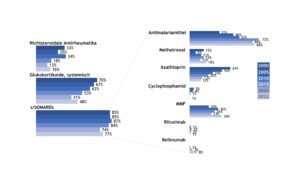
Abb. 15: Trends in der medikamentösen Therapie des SLE (Querschnittsdaten der Jahre 2000, 2005, 2010, 2015, 2020, 2022) (Vergrößerung durch Klick)
Krankheitsaktivität und patient(inn)enberichtete Outcomes beim SLE
Die mittlere Krankheitsaktivität lag nach Arzteinschätzung auf einer NRS (0 – 10, bester Wert = 0) zum Erfassungszeitpunkt bei den Patient(inn)en bei 1,2. Gemessen mit einer NRS (Wert ≤ 1) wiesen nach ärztlicher Einschätzung etwa 60% der Patient(inn)en eine inaktive Erkrankung auf.
Bei 206 Patient(inn)en wurde die Krankheitsaktivität zusätzlich anhand des Systemic Lupus Erythematosus Disease Activity Index 2000 (SLEDAI-2K) erhoben. Ein Gesamt-SLEDAI-2K von 0 steht für eine inaktive Erkrankung. Analog zur Einschätzung der Krankheitsaktivität mittels NRS wiesen auch anhand des SLEDAI-2K etwa 60% der Patient(inn)en eine inaktive Erkrankung auf. Bei knapp 19% lag eine hohe Krankheitsaktivität vor. Im Durchschnitt betrug der SLEDAI-2K 2,8.
Mehr SLE- als JIA-Patient(inn)en gaben bei der Befragung mittels CHAQ keine Funktionseinschränkungen im Alltag an. Über eine uneingeschränkte Alltagsfunktion berichteten 56% der Patient(inn)en, die mittlere Funktionseinschränkung betrug 0,3 (Abb. 16).
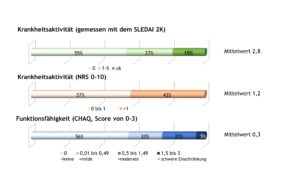
Abb. 16: Krankheitsaktivität (gemessen mit einer NRS) und Funktionseinschränkungen (gemessen mit den CHAQ) bei Patient(inn)en mit SLE (Daten 2022) (Vergrößerung durch Klick)
Ihren Gesundheitszustand schätzten Patient(inn)en mit SLE häufiger schlechter als Patient(inn)en mit JIA ein (NRS <1, SLE: 33%, JIA: 39%). Auf die Frage nach dem Zurechtkommen mit der Erkrankung gaben die Hälfte der Patient(inn)en mehr oder weniger große Probleme an, die Hälfte sah hier keinerlei Schwierigkeiten (NRS <1, Abb. 17).